VUmc protocol screening en behandeling bij chronische / doorgemaakte hepatitis B virusinfectie bij patiënten met chronisch gebruik van immuunsuppressiva, hematologische aandoeningen en stamceldonoren
Een opvlamming of reactivatie van een hepatitis B virus (HBV) infectie is een potentieel ernstige complicatie bij immuun verzwakkende therapieën zoals chemotherapie of immuunsuppressiva. Reactivatie van HBV is gedefinieerd als het detecteerbaar worden van de HBV-DNA load, danwel een stijging van het HBV-DNA met tenminste een factor 10 en met daarbij een significante stijging van het ALAT. Een reactivatie kan zeer ernstig verlopen, met leverfalen als gevolg, en identificatie van patiënten met een verhoogd risico is dus van groot belang. Daarnaast zijn ontvangers van infectieus allogeen materiaal ook at risk voor een HBV infectie. Over reactivatie van patiënten met een doorgemaakte HBV met antistofvorming (HBsAg-, anti-HBc+, anti-HBs+) is weinig bekend in literatuur. In tabel 1 wordt het risico op een opvlamming van HBV in bestaande en doorgemaakte infecties weergegeven.
Tabel 1
|
Therapie |
Kans op opvlamming bij bestaande HBV infectie (HBsAg+) |
Kans op reactivatie bij doorgemaakte HBV infectie (HBsAg-, Anti-HBc+) |
|
Anti CD-20 (bv. rituximab) |
30 – 60% |
> 10 % |
|
Antracyclines (chemotherapie) |
15 – 30% |
> 10% |
|
Allogene stamceltransplantatie |
11 – 86% |
14 – 50% |
|
Corticosteroïden 20 mg > 4 wkn < 20 mg > 4 wkn < 1 week |
> 10% 1 – 10% < 1% |
> 10%
<< 1% |
|
Anti TNF |
10% |
1% |
|
Lenalidomide Ibrutinib |
0.01 – 4% |
< 1% |
|
Methotrexaat / Azathioprine |
< 1% |
<< 1% |
|
Tyrosinekinaseremmers |
< 5% |
< 1% |
Identificatie van patiënten
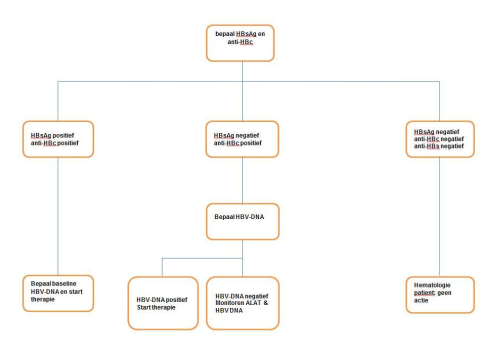
In de praktijk kan het lastig zijn om in te schatten wie een verhoogd risico heeft op een HBV-infectie, echter identificatie is belangrijk gezien de mogelijke dramatische gevolgen van een opvlamming. De HBV status moet zeker bepaald worden voorafgaand aan hoog risico therapie: anti-CD20-therapie, hoge dosis corticosteroïden, allogene stamceltransplantatie, chemotherapie en anti TNF therapie. Dit betekent dat de vrijwel elke hematologie patiënt in aanmerking komt voor een screening. Om de HBV status vast te stellen moet de patiënt getest worden op HBsAg, anti-HB core en anti-HBs.
- Een positieve HBsAg test wijst op HBV infectie.
Aanvullend onderzoek moet ingezet worden: HBeAg- en anti-HBe , IgM anti-HBcore,
HBV-DNA load. Er is sprake van chronische HBV infectie als HBsAg minstens 6 maanden
aantoonbaar is. Het aantreffen van HBsAg als toevalsbevinding bij screening duidt meestal
niet op recent opgelopen, maar op chronische HBV infectie. Chronische HBV infectie kan
verergeren onder immuunsuppressie, waarbij de HBV-DNA load stijgt en de
leverfunctieproeven verslechteren. Wanneer een patiënt geen chronische, maar acute
recente HBV infectie heeft dient altijd overleg plaats te vinden met een hepatoloog.
- Een positieve anti-core test bij een negatief HBsAg betekent: mogelijk doorgemaakte
HBV infectie.
Aanvullend moet ingezet worden: anti-HBs en anti-HBe. Als anti-HBs en/of anti-HBe ook
positief zijn, is er hoogstwaarschijnlijk sprake van doorgemaakte HBV infectie. Een geïsoleerd
positieve anti-HBcore test wijst ook op doorgemaakte, geklaarde HBV infectie, maar kan ook
fout-positief zijn. Er bestaat geen confirmatietest voor de anti-HBcore test. Overigens is bij
personen afkomstig uit midden- en hoog-endemische HBV gebieden een geïsoleerd positieve
anti-HBcore test meestal correct positief. Voor de zekerheid worden alle hematologische
patiënten met negatieve HBsAg test en positieve anti-HBcore test beschouwd als hebbende
een doorgemaakte HBV infectie. Onder immuunsuppressie kan doorgemaakte HBV infectie
reactiveren tot actieve HBV infectie (HBV-DNA en/of HBsAg worden weer aantoonbaar; met
eventueel ook ernstige klinische hepatitis).
Overzicht van de interpretatie van veel voorkomende HBV test profielen:
|
HBsAg – Anti-HBc – Anti-HBs – |
HBV naïve patiënt |
|
HBsAg – Anti-HBc + Anti-HBs + |
Natuurlijke immuniteit |
|
HBsAg – Anti-HBc – Anti-HBs + |
Status na vaccinatie |
|
HBsAg + Anti-HBc + IgM anti-HBc + Anti-HBs – |
Acute infectie |
|
HBsAg + Anti-HBc + IgM anti-HBc – Anti-HBs – |
Chronische infectie |
|
HBsAg – Anti-HBc + Anti-HBs – |
4 mogelijke interpretaties 1. Doorgemaakte infectie & immuun (meest voorkomend) 2. Geen infectie of immuniteit (vals positieve anti-HBc) 3. Occulte chronische infectie 4. Genezende acute infectie |
Opmerking:
Wanneer een patiënt aanvankelijk negatieve serologie had, maar vervolgens een serologisch profiel passend bij vaccinatie of bij doorgemaakte infectie krijgt, dan dient de passieve overdracht van antilichamen overwogen te worden, bijvoorbeeld via toediening van trombocyten of plasma.
1. Beleid bij patiënten die HBsAg+ zijn
Bij patiënten die HBsAg+ zijn moet, ongeacht de HBV-DNA load, profylactisch gestart worden met antivirale therapie. Twee HBV remmers komen hierbij in aanmerking:
1. Tenofovir (245 mg 1dd).
Ontwikkeling van resistentie tegen tenofovir, na aanvankelijke respons op de therapie, is nooit beschreven. Er is alleen sprake van kans op non-respons door pre-existente kruisresistentie met adefovir.
2. Entecavir (0,5 mg 1dd).
Resistentie tegen entecavir bij naïeve patiënten ontstaat bij 1,2 % binnen 2 jaar na start van de behandeling. Resistentie ontstaat echter frequent bij patiënten die eerder resistentie tegen oudere HBV remmers (lamivudine, adefovir of telbivudine) ontwikkelden. (Bij voorbehandelde patiënten is entecavir dosering: 1 mg 1 dd).
Tijdens de profylactische behandeling met een HBV remmer moet de effectiviteit van de profylaxe gecontroleerd worden door bepaling van de HBV-DNA load 2 maanden na start therapie en daarna halfjaarlijks. Bij behandelindicatie dient patient verwezen te worden naar de hepatoloog / MDL arts.
De optimale duur van de therapie staat niet vast, als leidraad wordt aangehouden:
- Patiënten die chemotherapie ondergaan of hoge dosis corticosteroïden krijgen tot minstens 6 maanden na de therapie antivirale behandeling.
- Patiënten die anti-CD-20 therapie ondergaan: tot minstens 12 maanden na hematologische therapie antivirale behandeling.
- Voor patiënten die een allogene SCT hebben ondergaan, geldt dat de duur en mate waarin een patiënt immuungecomprommiteerd is, individueel bepaald wordt door de conditionering, immuunsuppressie en het al dan niet ontwikkelen van graft-versus-host ziekte. HBV-geïnfecteerde patiënten dienen minstens 12 maanden na de allogene SCT en tot minstens 6 maanden na het staken van de immuunsuppressiva antiviraal behandeld worden.
2. Beleid bij patiënten die HBsAg – zijn, maar anti-HBc + en een aantoonbare HBV-DNA hebben
Voor deze groep patiënten geldt hetzelfde beleid als patiënten die HBsAg + zijn, nl antivirale therapie, met de hierboven beschreven middelen.
3. Beleid bij patiënten die HBsAg- , anti-HBc +, anti-HBs + en HBV-DNA negatief zijn
Voor deze groep patiënten geldt dat ze beschouwd kunnen worden als patiënten met volledige immuniteit en is het advies om de serumwaarde van het ALAT en HBV-DNA te monitoren. Als deze verhoogd zijn dan dienen HBsAg en anti-HBs antistoffen gecontroleerd te worden. Als er HBV-DNA aanwezig, dan moet antivirale therapie gestart worden. Is het virus onmeetbaar, dan moeten andere oorzaken van leverziekte worden uitgesloten.
Bij hoog risico therapie : rituximab: 1 x per 3 maanden, ook in follow up en bij allogene stamceltransplantatie 1 x per 2 maanden, zo lang als patiënt immuunsupressie krijgt.
Eventueel kan worden overwogen om in deze groep patiënten antivirale therapie te starten bij hen die een allogene stamceltransplantatie ondergaan of anti-CD20 krijgen toegediend.
4. Beleid bij patiënten die HBsAg – , anti HBc- en anti-HBs – zijn
Voor deze groep patiënten geldt dat ze gevaccineerd moeten worden tegen hepatitis B, indien de tijdsspanne het toelaat. Dit is bij de gemiddelde hematologie patiënt niet haalbaar, door bijvoorbeeld acute ziekte.
5. Beleid bij donoren voor allogene stamceltransplantatie met chronische of doorgemaakte HBV infectie (bij HBV naïeve ontvangers)
A. Donor met chronische HBV infectie (HBsAg positief)
Een persoon met chronische HBV infectie is in principe niet geschikt als stamceldonor. Er kunnen echter redenen zijn om toch van een HBV geïnfecteerde donor gebruik te maken. De afweging hierbij dient zorgvuldig in de status van donor en patiënt vermeld te worden. Zo mogelijk dient de donor verwezen te worden naar een hepatoloog voor behandeling met een HBV remmer, minimaal 4 weken pre-donatie en bij voorkeur totdat HBV-DNA negatief is. Indien de donor ten tijde van de stamceldonatie HBV-DNA positief is, dient de patiënt antiviraal behandeld te worden maar ook bij een donor die onder antivirale therapie HBV DNA-negatief is, lijkt dit raadzaam. Vaccinatie van de patiënt is vaak niet effectief, omdat deze reeds immuungecompromitteerd is. Een patiënt met anti-HBs < 100 IE/L moet 1 dag voor de transplantatie HBV immunoglobuline toegediend krijgen (Hepbequin 500 IE). Het stamcelprodukt moet zo min mogelijk plasma bevatten en HBV-DNA moet op een monster van het stamcelprodukt bepaald worden. Drie, 6 en 12 maanden na de stamceltransplantatie moet de patiënt gecontroleerd worden op HBV infectie middels een HBV-DNA test; en vaker in geval van onvoldoende verklaarde stijging van transaminasen.
B. Donor met doorgemaakte HBV infectie (HBsAg-negatief, anti-HBcore positief)
Bij een donor met een doorgemaakte HBV infectie zijn er 3 scenario’s denkbaar.
- Geschikt als stamceldonor: anti-HBs > 100 IE/L en HBV-DNA niet aantoonbaar
Een persoon met doorgemaakte HBV infectie is alleen geschikt als stamceldonor als er sprake
is van een anti-HBs titer > 100 en negatief HBV-DNA. Bij donoren met een anti-HBs titer > 100
en negatief HBV-DNA is de kans op HBV transmissie verwaarloosbaar klein en kan afgezien
worden van profylactische medicatie dan wel monitoring. Wel is het advies om de patiënt
1 dag voor de transplantatie eenmalig HBV immunoglobuline toe te dienen
(Hepbequin 500 IE).
- Formeel ongeschikt (‘ineligible’) als stamceldonor: anti-HBs < 100 IE/L en negatief HBV-DNA
Er kunnen redenen zijn toch een donor te accepteren die niet aan de genoemde criteria
voldoet. De afweging hierbij dient zorgvuldig in de status van donor en patiënt vermeld
te worden.
Het beleid is vervolgens als volgt:
-
- De HBV naïeve patiënt moet 1 dag voor de transplantatie HBV immunoglobuline toegediend krijgen (Hepbequin 500 IE).
- Het stamcelprodukt moet zo min mogelijk plasma bevatten.
- Drie, 6 en 12 maanden na de stamceltransplantatie moet de patiënt gecontroleerd worden op HBV infectie middels een HBV-DNA test; en vaker in geval van onvoldoende verklaarde stijging van transaminasen.
- Formeel ongeschikt (‘ineligible’) als stamceldonor: HBsAg-negatieve, anti-HBcore positieve donoren met aantoonbaar HBV-DNA
Beleid volgens paragraaf A.
6. Beleid bij patiënten die laag risico therapie ondergaan
Laag risico therapie is o.a. methotrexaat en azathioprine. Voor deze patiëntengroep geldt dat degene met een chronische, occulte of doorgemaakte HBV infectie frequente monitoring van het ALAT en, bij stijging hiervan, HBV-DNA dient te gebeuren.
Figuur 1:
Stroomdiagram voor diagnostiek en therapie bij hepatitis B, bij patiënten die hoog risico immuunsuppressieve / chemotherapie moeten ondergaan.
Wijzigingen t.o.v. vorige versie
Ibrutinib toegevoegd aan therapie