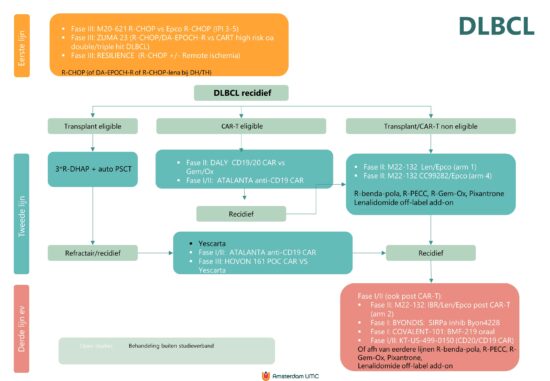
Flowdiagram Studies en standaardbehandeling
Wijzigingen t.o.v. vorige versie
16-2-2024:
Deze website is in onderhoud.
Informatie over DLBCL volgt.
15-3-2024: studie overzicht toegevoegd.
16-2-2024:
Deze website is in onderhoud.
Informatie over DLBCL volgt.
15-3-2024: studie overzicht toegevoegd.